教育背景
2004-2008 华东理工大学 学士
2008-2009 瑞典厄勒布鲁大学 硕士
2009-2012 爱尔兰国立大学-高威 博士后
工作经历
2013-2020 美国加州大学旧金山分校 博士后
2020-2023 清华大学药学院 助理教授
2023-至今 清华大学药学院 副教授
研究方向
2)药物设计:利用计算化学与人工智能方法设计小分子药物和抗体药物;
3)全细胞模型:融合多组学数据,建立基于数据的全细胞模型,预测外来分子与细胞的相互作用。
科学贡献
1.复杂酶催化反应产物的预测
2.基于量子化学的生物化学和有机化学反应产物计算器
科研成果
1.萜类化合物合成酶(Terpene Synthases)反应产物的预测
萜类化合物合成酶可以催化合成极为复杂的多碳环骨架的萜类化合物,其中有很多是重要的药物前体或药物中间体,例如抗癌药物紫杉醇。到2019年6月,已经被FDA认证的药物中约有9%的化合物具有萜类化合物的母核。萜类化合物合成酶催化的碳正离子重排过程非常复杂,产物的可能性数以亿计,目前已经报道的萜类天然产物就已经达到了80000多种。
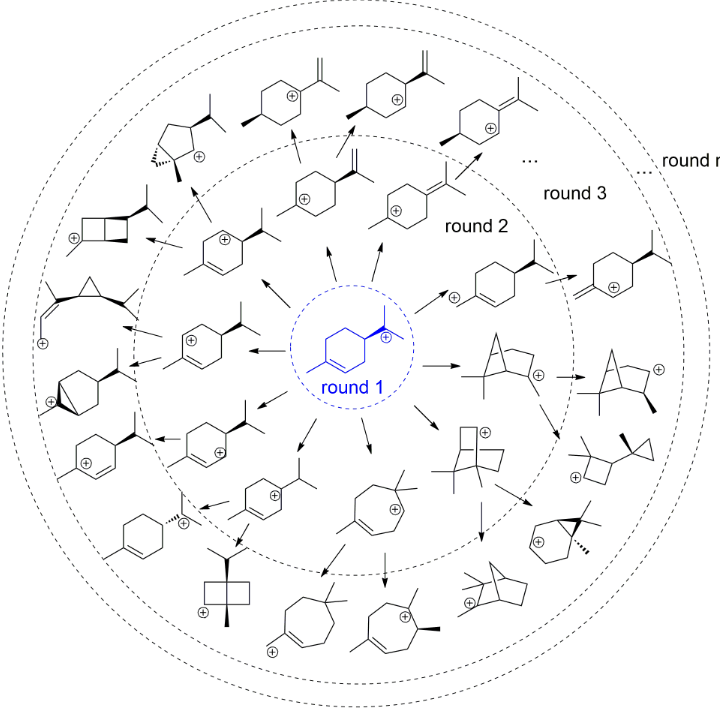
针对第一类萜类化合物合成酶,我们首先编写了计算机程序,成功绘制出完整的碳正离子重排中间体的化学反应网络。利用这个网络,结合碳正离子能量的计算可以推算出每个产物的最优反应路径。基于这个程序,我们在全球范围内首次推算出单萜类(C10)总共包含了18000多个可能的碳正离子,可以用74个不同的环化骨架来代表。利用这一方法,我们根据已知的蛋白质序列预测了一种全新功能的倍半萜类化合物合成酶,并得到实验验证。
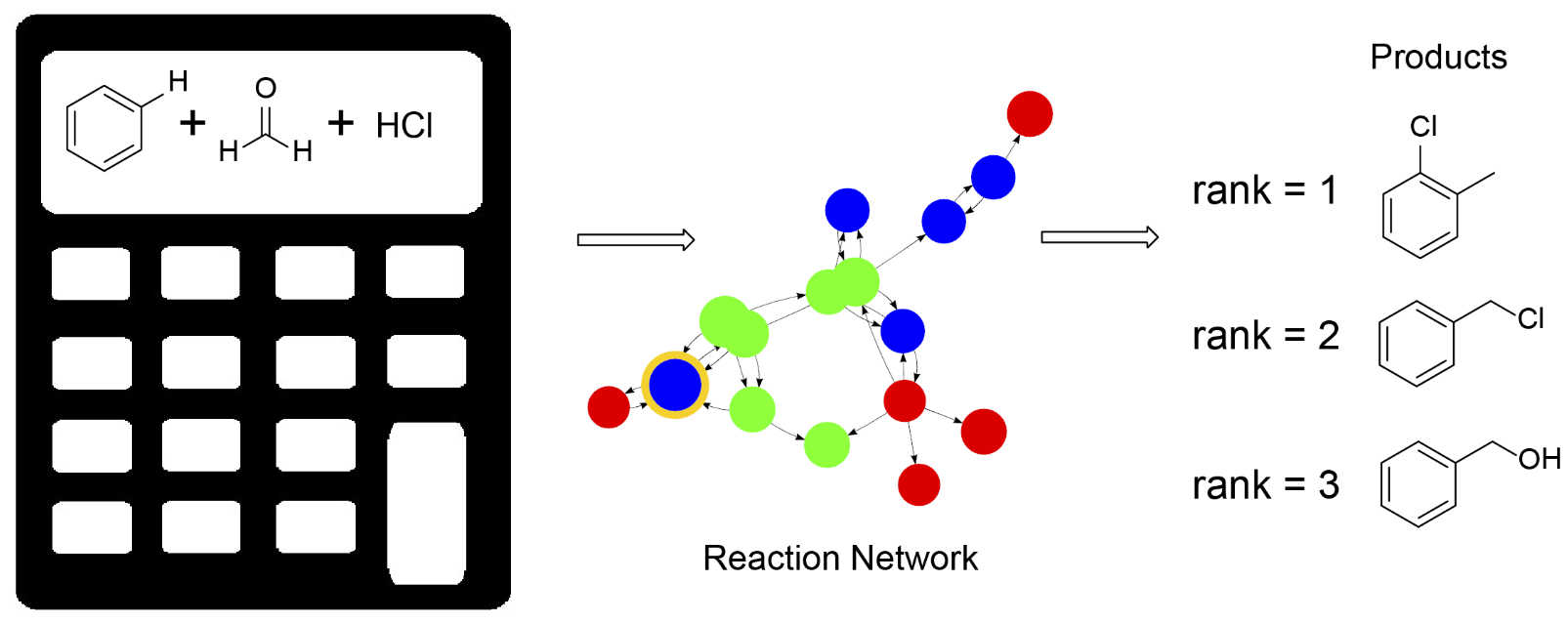
2.生物化学和有机化学的反应计算器
FDA批准的药物必须包含其中所有的化合物的信息。在药物合成的过程中很多少量的副产物结构很难确定,人工推断副产物需要花费大量的时间。我们的主要目标是,在仅知道反应物的情况下,通过计算机模拟,自动确定反应的可能产物、副产物以及反应机理。这个功能类似传统意义的数学计算器,只需要输入反应物分子,就可以得到一个包含可能产物的化学反应网络。我们目前已经研发出基于量子化学的反应计算器,并且测试了70个有机化学人名反应作为验证(https://namedreactions.jacobsonlab.org/)。
代表性论文
2. F. J. Cortez, P. Nguyen, C. Truillet, B. Tian, K. M. Kuchenbecker, M. J Evans, P. Webb, M. P Jacobson, R. J. Fletterick, P. M. England. Development of 5N-Bicalutamide, A High-affinity Reversible Covalent Antiandrogen. ACS Chem. Biol. 2017, 12, 2934-2939.
3. B. Tian, C. D. Poulter, M. P. Jacobson. Defining the Product Chemical Space of Monoterpenoid Synthases. PLOS Comp. Bio. 2016, 12(8), e1005053.
4. J. Y. Chow, B. Tian (Co-first author), G. Ramamoorthy, B. S. Hillerich, R. D. Seidel, S. C. Almo, M. P. Jacobson, C. D. Poulter. Computational-guided discovery and characterization of a sesquiterpene synthase from Streptomyces clavuligerus. Proc. Natl. Acad. Sci. USA, 2015, 112, 5661-5666.
5. G. Ramamoorthy, M. L. Pugh, B. Tian, R. M. Phan, L. B. Perez, M. P. Jacobson, C. D. Poulter. Synthesis and Enzymatic Studies of Bisubstrate Analogues for Farnesyl Diphosphate Synthase. J. Org. Chem. 2015, 80, 3902-3913.
6. B. Tian, F. H. Wallrapp, G. L. Holiday, J. Y. Chow, P. C. Babbitt, C. D. Poulter, M. P. Jacobson. Predicting the functions and specificity of triterpenoid synthases: A mechanism-based multi-intermediate docking approach. PLOS Comp. Bio. 2014, 10, e1003874.
7. S. Krishnan, R. M. Miller, B. Tian, R. D. Mullins, M. P. Jacobson, J. Taunton. Design of reversible, cysteine-targeted Michael acceptors guided by kinetic and computational analysis. J. Am. Chem. Soc. 2014, 136, 12624-12630.
8. M.P. Jacobson, C. Kalyanaraman, S. Zhao, B. Tian. Leveraging structure for enzyme function prediction: methods, opportunities, and challenges. Trends Biochem. Sci. 2014, 39, 363-371.
9. B. Tian, F. H. Wallrapp, C. Kalyanaraman, S. Zhao, L. A. Eriksson, M. P. Jacobson. Predicting Enzyme-Substrate Specificity with QM/MM Methods: A Case Study of the Stereo-specificity of D-glucarate Dehydratase. Biochemistry 2013, 52, 5511-5513.
10. B. Tian, N. An, W. P. Deng, L. A. Eriksson. Catalysts or Initiators?-Beckmann Rearrangement Revisited. J. Org. Chem. 2013, 78, 6782-6785.
11. N. An, B. Tian, L. A. Eriksson, W. P. Deng. Mechanistic Insight into Self-Propagation of Organo-Mediated Beckmann Rearrangement: A Combined Experimental and Computational Study. J. Org. Chem. 2013, 78, 4297-4302.
12. B. Tian, L. A. Eriksson. Catalytic Mechanism and Product Specificity of Oxidosqualene-Lanosterol Cyclase: A QM/MM Study. J. Phys. Chem. B 2012, 116, 13857-13862.
13. B. Tian, E. Erdtman, L. A. Eriksson. Catalytic Mechanism of Porphobilinogen Synthase: The Chemical Step Revisited by QM/MM Calculations. J. Phys. Chem. B 2012, 116, 12105-12112.
14. B. Tian, L. A. Eriksson. Catalytic Mechanism and Roles of Arg197 and Thr183 in the Staphylococcus aureus Sortase A Enzyme. J. Phys. Chem. B 2011, 115, 13003-13011.
15. B. Tian, L. A. Eriksson. Structural changes of Listeria Monocytogenes Sortase A: A key to understanding the catalytic mechanism. Proteins: Struct., Funct., Bioinf. 2011, 79, 1564-1572.
16. B. Tian, L. A. Eriksson. Catalytic Roles of Active Site Residues in 2-Methyl-3-hydroxypyridine-5-carboxylic Acid Oxygenase: An ONIOM/DFT Study. J. Phys. Chem. B 2011, 115, 1918-1926.
17. B. Tian, E. Eriksson, L. A. Eriksson. Can range-separated hybrid DFT functionals predict low-lying excitations? A Tookad case study. J. Chem. Theory Comput. 2010, 6, 2086-2094.
18. B. Tian, Y. Tu, Ǻ. Strid, L. A. Eriksson. Hydroxylation and Ring-opening Mechanism of an Unusual Flavoprotein Monooxygenase, 2-Methyl-3-hydroxypyridine-5-carboxylic Acid Oxygenase: A Theoretical Study. Chem. Eur. J. 2010, 16, 2557-2566.